うっ血肝モデルマウスにおいてスフィンゴシン1リン酸(S1P)は肝線維化と腫瘍増大を促進する
Sphingosine-1-phosphate promotes tumor development and liver fibrosis in mouse model of congestive hepatopathy
Hironari Kawai, Yosuke Osawa, Michitaka Matsuda, Tomoyuki Tsunoda, Keisuke Yanagida, Daisuke Hishikawa, Miku Okawara, Yuzuru Sakamoto, Tomonari Shimagaki, Yuriko Tsutsui, Yuichi Yoshida, Shiori Yoshikawa, Kana Hashi, Hiroyoshi Doi, Taizo Mori, Taiji Yamazoe, Sachiyo Yoshio, Masaya Sugiyama, Daisuke Okuzaki, Haruki Komatsu, Ayano Inui, Miwa Tamura-Nakano, Chinatsu Oyama, Hideo Shindou, Hironori Kusano, Masayoshi Kage, Toru Ikegami, Katsuhiko Yanaga, Tatsuya Kanto.
Hepatology 2022 Jul;76(1):112-125. doi: 10.1002/hep.32256.
1.研究の背景
うっ血肝*1は、右心不全やバッド・キアリ症候群、Fontan術後肝障害 (FALD) など肝上下大静脈のうっ滞に引き続き生じる病態で、長期経過において肝硬変、肝癌へと進展することが知られています。しかし、うっ血性肝線維化、発癌の機序は不明な点が多く、治療法が限られているのが現状です。今回我々は肝上下大静脈部分結紮 (partial Inferior Vena Cava Ligation: pIVCL) によるうっ血肝モデルマウスを用いた検討により、慢性肝うっ血がジエチルニトロサミン (DEN) 誘導肝癌、転移性肝癌の増大を促進することを見出しました。そこで近年、腫瘍増殖や線維化への関与が明らかになりつつある脂質メディエーターの一つであるスフィンゴシン1リン酸 (S1P)*2 に着目して、うっ血性肝線維化、発癌へのS1Pの関与をうっ血肝モデルマウスを用いて検討することとしました。
2.研究成果
- 慢性うっ血は肝発癌と肝線維化を誘導する
はじめにpIVCLによるうっ血肝モデルマウスの肝臓を時間経過に沿って解析しました。
すると、術後6週で肝線維化を(図1A, B)、術後54週で約半数のマウスで肝腫瘍を認めました (図1A, C, D)。また肝線維化は時間経過とともに徐々に増悪をきたしました。これらの所見から、慢性うっ血は肝発癌と線維化を誘導することが明らかになりました。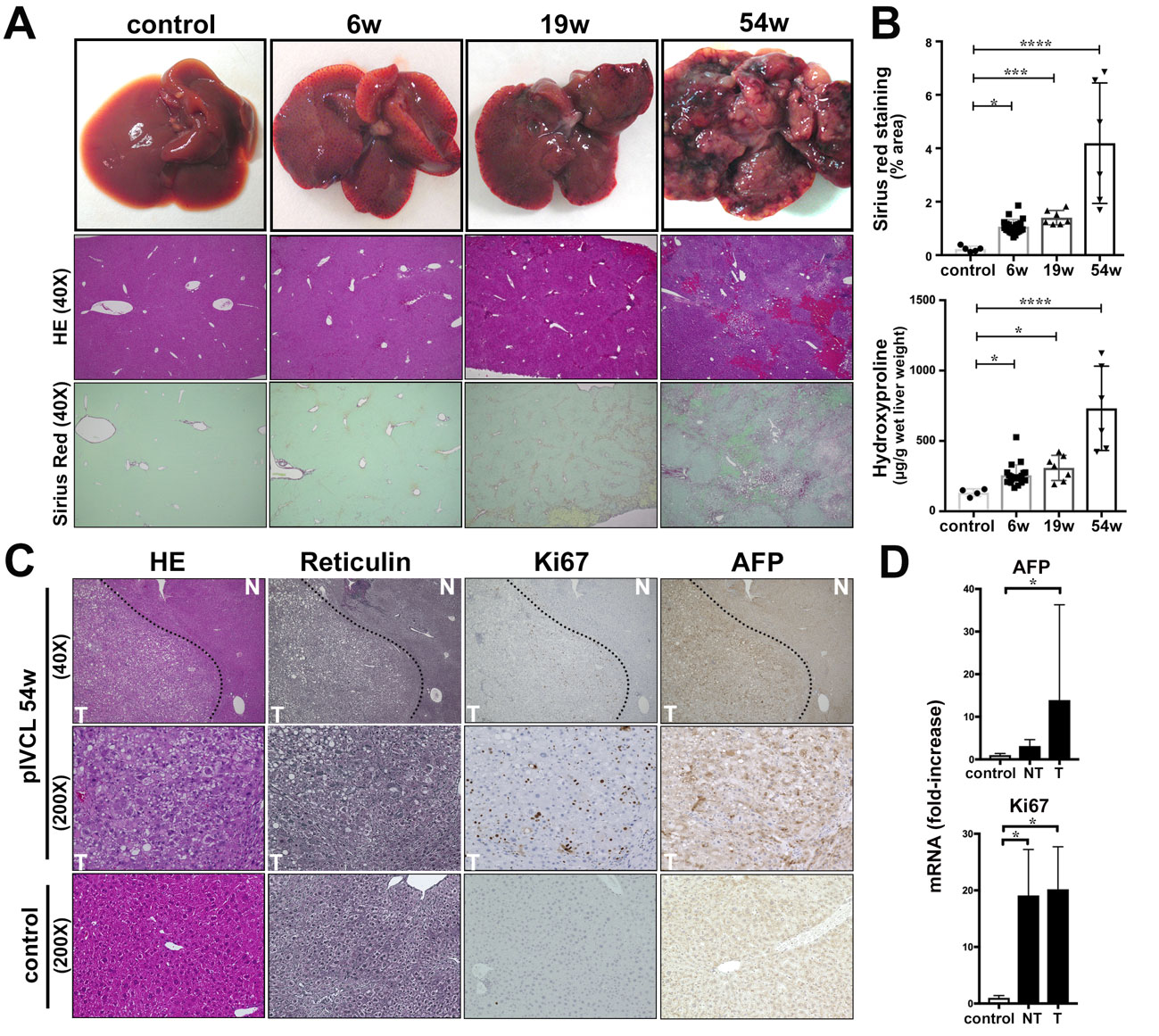
図1. (A) 時系列でのpIVCLマウスの肝肉眼所見 (上段), H-E染色 (中段), Sirius red 染色 (下段). (B) Sirius red 染色とヒドロキシプロリン測定によるコラーゲン定量. (C) 術後54週とコントロールの組織染色像 (左よりH-E染色, 都銀染色, Ki67染色, AFP染色) [腫瘍部 (T) と非腫瘍部 (N)]. (D) AFPとKi67の正常肝、術後54週での腫瘍部、非腫瘍部におけるmRNA発現解析.
- 慢性うっ血はDEN誘導肝癌増大を促進する
続いて慢性うっ血が腫瘍増大を促進するかどうかを、DEN誘導肝癌モデルマウスにsham手術またはpIVCL手術を施行し検討しました。DEN+pIVCLマウスでは、術後19週で全例に多発腫瘍と、腫瘍増大に伴う肝重量増加を認めました。一方、DEN+sham マウスでは、極少数の腫瘍を一部のマウスに認めるのみでした (図2A, B)。以上より、うっ血肝モデルマウスにおいて、慢性肝うっ血は原発性肝癌増大を促進することが明らかになりました。
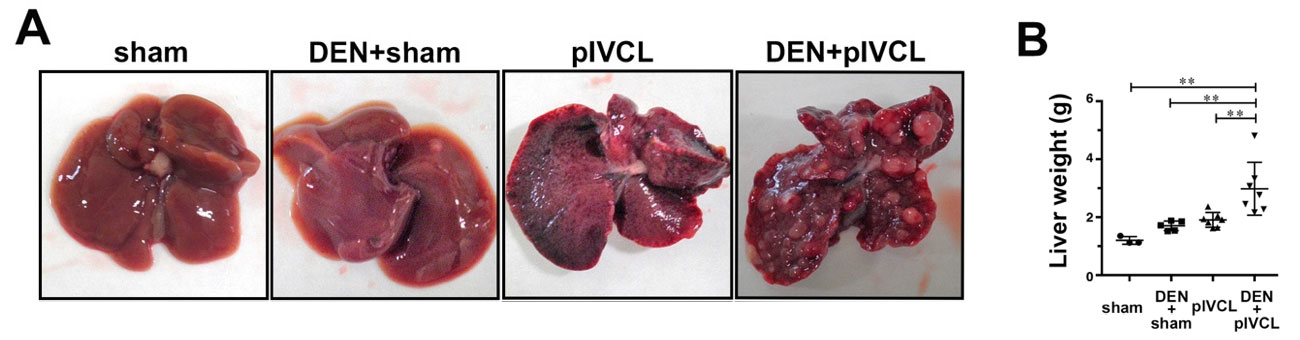
図2. (A) 左よりsham単独、DEN投与sham、pIVCL単独、DEN投与pIVCL マウスの肝肉眼所見(術後19週). (B) 肝重量.
-
慢性うっ血は Endothelin 1 (ET-1), Angiopoietin 2 (ANGP-2) の発現上昇を誘導する
うっ血性肝線維化、腫瘍増大に寄与する因子を探索するために、線維化、肝癌関連PCR array を施行しました。うっ血肝ではET-1やANGP-2の発現上昇を認め (図3A, B)、他の肝線維化モデルマウスに比し、肝内及び血漿中での有意なET-1, ANGP-2上昇を認めました (図3C)。さらにうっ血肝患者 (FALD患者) の血清を測定すると、ET-1, ANGP-2共に健常人、HCV患者より有意に高値を示すことが確認されました (図3D)。これらのデータより、ET-1とANGP-2発現上昇はうっ血性肝線維化・腫瘍増大と関連している可能性が示唆されました。
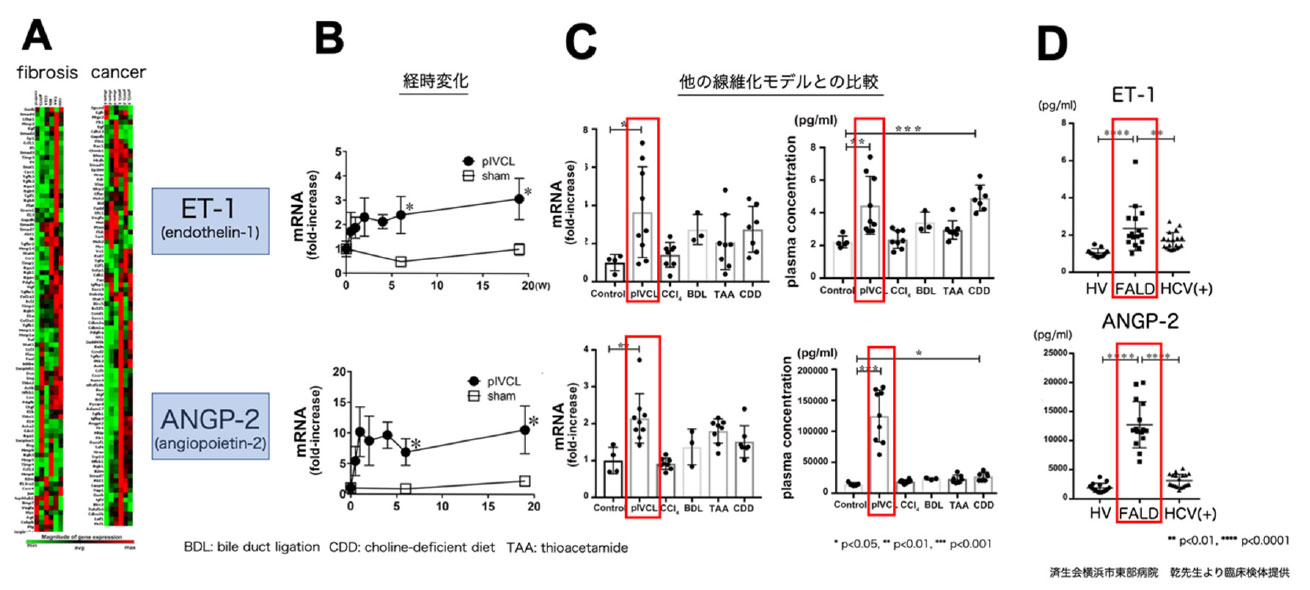
図3. (A) 線維化関連、肝癌関連PCR arrayのHeatmap. (B) 時系列でのET-1, ANGP-2 肝内mRNA発現解析. (C) 複数の肝線維化モデルマウス間でのET-1, ANGP-2 mRNA発現解析 (左図)と血漿解析 (右図). (D) FALD患者の血清ET-1とANGP-2測定.
-
慢性うっ血は肝類洞内皮細胞の毛細血管化を誘導する
ET−1やANGP-2はアンジオクラインと総称され、主に血管内皮細胞から産生される因子であり、ET-1は肝類洞内皮細胞の毛細血管化と呼ばれる形態変化のサロゲートマーカーとして知られている事から、うっ血肝における線維化・腫瘍増大に肝類洞内皮細胞が関与していると考え、肝類洞内皮細胞の形態変化を電子顕微鏡で評価することとしました。すると、うっ血肝では肝類洞内皮細胞の毛細血管化(有孔消失、基底膜様構造出現、サロゲートマーカーとしてのET-1/CD31発現上昇) が誘導されている事が分かりました(図4A)。さらにFA LD患者においても、透過型電子顕微鏡像にて基底膜様構造の出現を認め、さらに肝類洞内皮細胞毛細血管化のサロゲートマーカーであるCD31の発現上昇を認めました (図4B)。これらの所見より、慢性肝うっ血は肝類洞内皮細胞の毛細血管化を人とマウスモデルで誘導する事が確認されました。
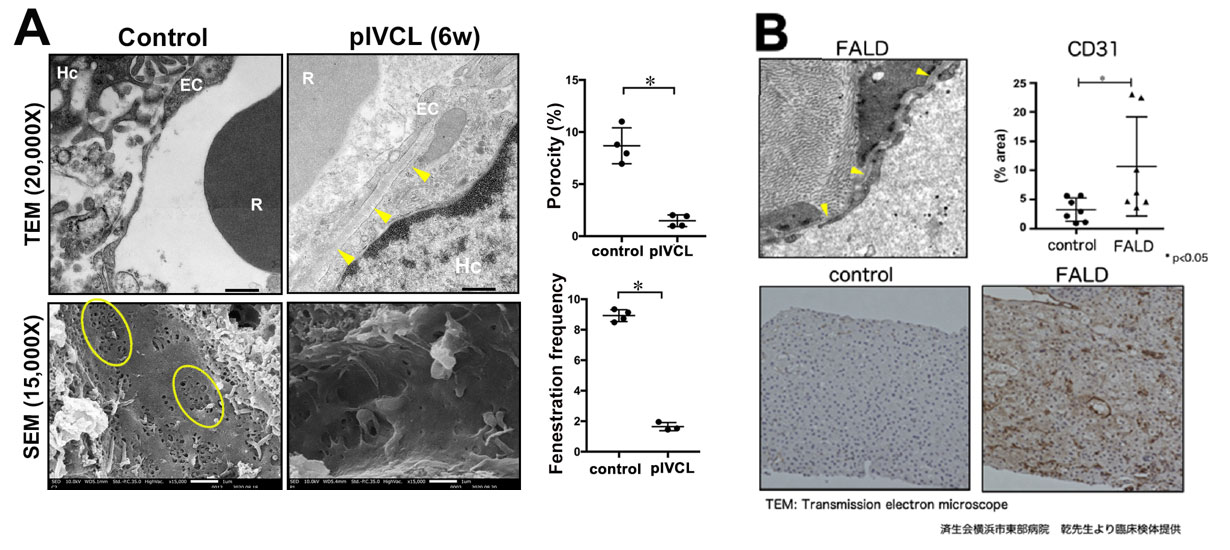
図4. (A: 左上段) 透過型電子顕微鏡像. pIVCL術後6週において、肝類洞内皮細胞と肝細胞微絨毛間に基底膜様構造 (矢頭)を認める. (A: 左下段) 走査型電子顕微鏡像. pIVCL術後6週において、肝類洞内皮細胞の篩板状構造内の有孔 (実線) が消失、減少している (Hc, hepatocyte; EC, endothelial cell; R, red blood cell). (A: 右図) 肝類洞内皮細胞の有孔面積・有孔数定量化. (B) FALD患者肝生検サンプルを用いた透過型電子顕微鏡像の代表例. 基底膜様構造 (矢頭)が認められる(左上段). CD31陽性面積 (%)の定量化(右上段). FALD 患者とコントロール患者におけるCD31免疫染色の代表例(下段).
-
スフィンゴシン1リン酸 (S1P) はうっ血性肝線維化と腫瘍増大に関与する.
肝類洞内皮細胞の毛細血管化がうっ血性肝線維化・腫瘍増大へ関与するかを明らかにするために、S1Pに着目して解析を行いました。うっ血性肝線維化・肝癌モデルマウスでは、肝内S1Pの増加を認め、S1Pの主要合成酵素であるSphK1が毛細血管化した肝類洞内皮細胞で主に発現していることが分かりました。そこで、S1Pがうっ血性肝線維化・腫瘍増大に寄与するかを調べるために、各S1P受容体 (S1PR) 阻害剤 (S1PR1; Ex26, S1PR2; JTE013, S1PR3; CAY10444) を用いた阻害実験を施行しました。うっ血性肝線維化モデルにおいて、S1PR2阻害剤 (JTE013) 投与で部分的な線維化抑制効果を認めた一方、S1PR1 (Ex26) と S1PR3 (CAY10444) 投与では線維化抑制効果を認めませんでした (図5A, B)。次にうっ血性肝癌モデルを用いて、腫瘍増大へのS1P関与を検討しました。S1PR1 (Ex26) 阻害剤投与により、うっ血性肝癌増大は抑制されました (図5C)。さらに、肝細胞特異的S1PR1KOマウスにおいてもうっ血性肝癌増大は抑制されました (図5D)。以上より、うっ血肝において、肝線維化にはS1P/S1PR2を介した経路が、原発性肝癌増大にはS1P/S1PR1を介した経路の活性化が一つの機序として関与すると考えられました。
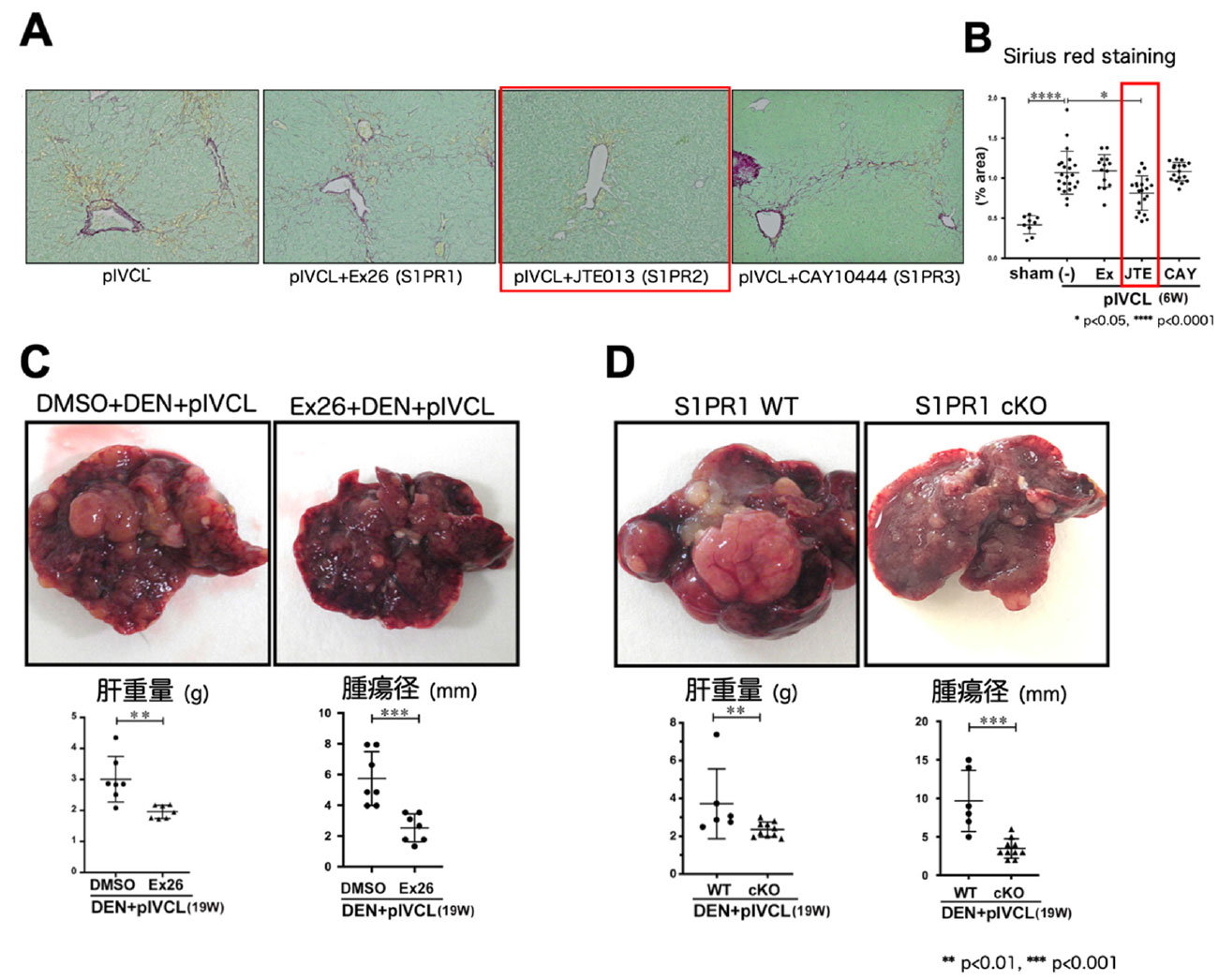
図5. (A) Sirius red 染色. (B) ImageJによるSirius red 染色定量. (C) DEN誘導肝癌モデルへのEx26投与有無による肝肉眼所見 (上段) と肝重量、腫瘍径定量 (下段). (D) 肝細胞特異的S1PR1ノックアウトマウスとコントロールマウスでのうっ血性肝癌モデルにおける肝肉眼所見 (上段) と肝重量、腫瘍径定量 (下段).
-
腸内殺菌は肝類洞内皮細胞毛細血管化、うっ血性肝線維化、腫瘍増大を抑制する.
最後に、肝類洞内皮細胞の毛細血管化がどのような機序で生じているのかを検討しました。うっ血性肝癌モデルにおいてコントロール群に比し、門脈血中LPSが有意に上昇していたため、腸内毒素であるLPSの関与を検討しました。C57BL/6JマウスにLPSを腹腔内投与したところ、肝内CD31, SphK1, ET-1, ANGP-2 の発現上昇を認めました。さらに、初代培養肝類洞内皮細胞へのLPS添加実験では、CD31とSphK1の発現上昇が誘導されました。 さらに、うっ血性肝線維化・腫瘍増大における腸内殺菌の影響を検討するために、うっ血性肝線維化・肝癌モデルに抗生剤投与を施行すると、肝線維化・腫瘍増大は顕著に抑制されました (図6A)。うっ血性肝癌モデルにおいて、抗生剤投与により門脈血中LPS増加は抑制され、肝臓内CD31, SphK1, ET-1, ANGP-2の発現も癌部・非癌部ともに抑制されました (図 6B)。さらに肝内S1Pと血漿中ANGP-2濃度も抗生剤投与により有意に減少しました (図6C)。これらの結果より、LPSはSphK1, ET-1, ANGP-2の発現上昇を伴う肝類洞内皮細胞の毛細血管化、それに引き続くうっ血性肝線維化、腫瘍増大を促進している事が示唆されました。
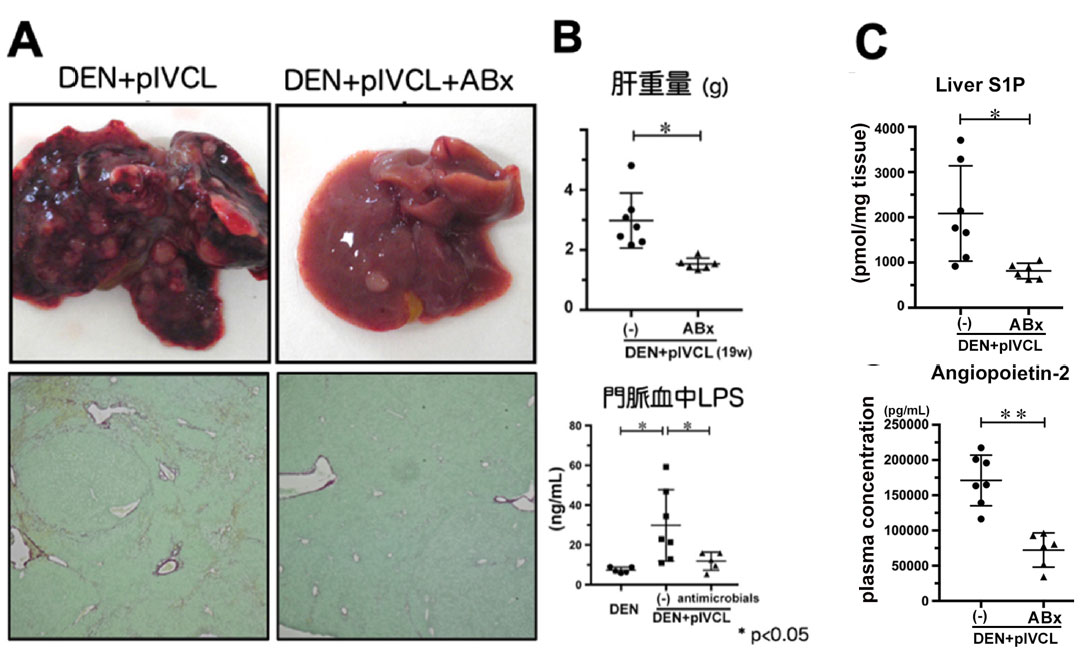
図6. (A) うっ血性肝癌マウスへの抗生剤投与有無での肉眼所見 (上段)、H-E染色 (下段). (B) 肝重量と門脈血中LPS定量. (C) 肝内S1Pと血漿ANGP-2定量.
-
まとめ
本研究により
(1)慢性肝うっ血により原発性・転移性肝癌の増大が促進される事(2)腸管由来LPSが肝類洞内皮細胞 (LSEC) の毛細血管化と、毛細血管化したLSECでのS1P合成酵素発現上昇を誘導する事(3)毛細血管化したLSEC由来のスフィンゴシン1リン酸 (S1P) がS1PR2を介してうっ血性肝線維化を、S1PR1を介してうっ血性肝線維化を、S1PR1を介してうっ血性肝癌増大を誘導する事を明らかにしました(図7)。本研究で得られた知見は、今後うっ血性肝線維化・発癌における新たな治療戦略に繋がる可能性が示唆されます。
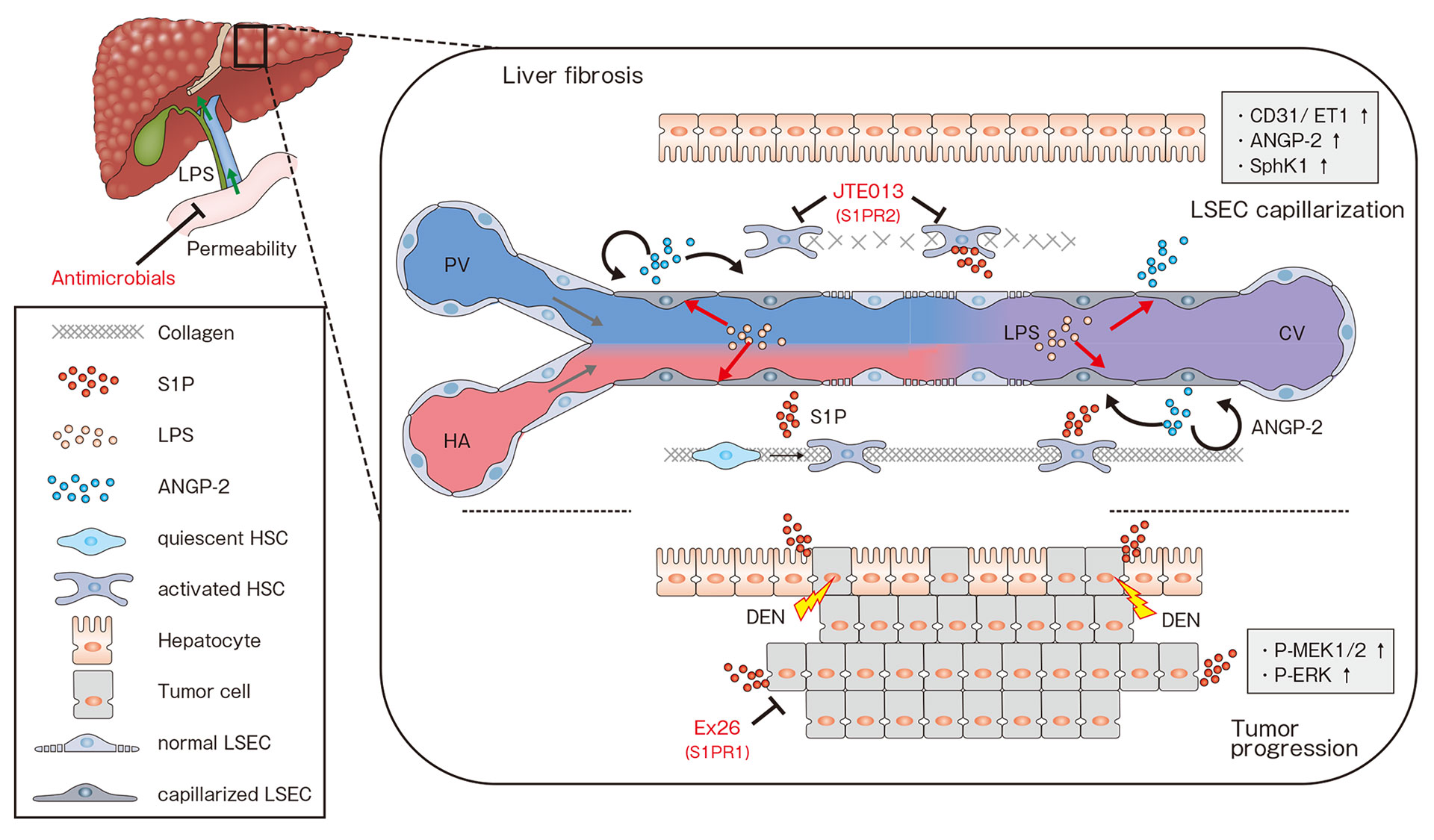
図7 うっ血性肝線維化、腫瘍増大において想定される機序のモデル図.
慢性肝うっ血により門脈圧亢進、腸管透過性亢進に引き続き、門脈血中LPSの上昇が生じる。腸管由来LPSや、非実質細胞より分泌されたANGP-2 のオートクライン・パラクライン作用により、肝類洞内皮細の毛細血管化が誘導され、その後SphK1発現上昇を生じる。毛細血管化した肝類洞内皮細胞由来のS1PはS1PR2を介した肝星細胞の活性化により、またS1PR1を介した肝細胞、腫瘍細胞の活性化により線維化、腫瘍増大を促進する。
LPS; lipopolysaccharide, ANGP-2; angiopoietin-2, HSC; hepatic stellate cell, LSEC; liver sinusoidal endothelial cell, S1P; sphingosine-1-phosphate, PV; portal vein, CV; central vein, HA; hepatic artery.
用語解説
*1. うっ血肝:肝臓を循環した血液は、肝静脈、下大静脈を経由し心臓に戻ります。その通り道が何かしらの原因により障害され、血液が肝臓で渋滞を起こした状態です。この状態が持続すると、長期経過で肝硬変、肝癌へと進展していくことが知られています。ウイルス肝炎や脂肪肝炎と異なり炎症反応が軽微であるにも関わらず、線維化、発癌をきたすことから、従来とは異なる機序の存在が想定されています。
*2. S1P:複数の臓器で線維化・腫瘍増大に関与する脂質メディエーターの一つで、主に血管内皮細胞と赤血球、血小板によって産生される事が知られています。肝癌をはじめとする担癌患者さんの癌組織中や血液中で、S1Pが増加することが知られています。